
Η έρευνα του Εργαστηρίου Μοριακής Γενετικής επικεντρώνεται στους μηχανισμούς της χρόνιας φλεγμονής και της παθογένειας του ανοσοποιητικού συστήματος, καθώς και στην αλληλεπίδραση του ανοσοποιητικού με το Κεντρικό Νευρικό Σύστημα (ΚΝΣ). Απώτερος σκοπός είναι η μεταβίβαση της γνώσης από τα πειραματικά μοντέλα στην ανθρώπινη ασθένεια, με στόχο την εύρεση νέων βιοδεικτών και θεραπευτικών προσεγγίσεων.
Η ομάδα Probert διερευνά τους ανοσολογικούς μηχανισμούς που ελέγχουν τη φλεγμονή, την απομυελίνωση και την επαναμυελίνωση του Κεντρικού Νευρικού Συστήματος (ΚΝΣ) σε ασθένειες όπως η Σκλήρυνση κατά Πλάκας (ΣΚΠ) (1). Ο γενικός στόχος της έρευνας είναι ο εντοπισμός μηχανισμών που προάγουν τη νευροπροστασία και την επιδιόρθωση του εγκεφάλου, καθώς και ο εντοπισμός νέων θεραπευτικών στόχων για την πρόληψη της μετάβασης της ΣΚΠ από την υποτροπιάζουσα-διαλείπουσα φάση (RRMS) που θεωρείται κυρίως φλεγμονώδης, στη δευτερογενή προϊούσα φάση (PMS) που θεωρείται κυρίως νευροεκφυλιστική, και είναι ανθεκτική στις τρέχουσες ανοσοθεραπείες.
Μακροχρόνιο ερευνητικό ενδιαφέρον αποτελεί η κατανόηση της πολύπλοκης βιολογίας του παράγοντα νέκρωσης όγκων (tumor necrosis factor-TNF) στο ΚΝΣ. Η έρευνα του εργαστηρίου μας και άλλων, συνέβαλε στην ταυτοποίηση των κυττάρων και των μοριακών μηχανισμών που είναι απαραίτητα για τη συντήρηση και την επιδιόρθωση της μυελίνης καθώς και την προστασία των νευρώνων μέσω του TNF σε χρόνιες φλεγμονώδεις συνθήκες (2–6). Η γνώση αυτή συνέβαλε σημαντικά στην ανάπτυξη νέων επιλεκτικών αναστολέων του TNF που αναστέλλουν τις βλαβερές επιδράσεις του μονοπατιού σηματοδότησης του διαλυτού TNF/ TNF υποδοχέα 1, ενώ διατηρούν τα ευεργετικά αποτελέσματα του διαμεμβρανικού TNF/TNF υποδοχέα 2, ως αντι-ΤΝF θεραπείες νέας γενιάς για τις φλεγμονώδεις νόσους, συμπεριλαμβανομένης της ΣΚΠ (7). Με αυτό το υπόβαθρο, η τρέχουσα έρευνα στοχεύει να κατανοήσει περαιτέρω πώς τα ανοσοκύτταρα του εγκεφάλου αλλάζουν μεταξύ ευεργετικών και επιβλαβών λειτουργιών κατά τη χρόνια φλεγμονή, καθώς και τις επιπτώσεις της αυξημένης ηλικίας και της κυτταρικής γήρανσης σε αυτούς τους μηχανισμούς. Στόχος αποτελεί επίσης η κατανόηση των μηχανισμών αντιγονο-ειδικής ανοσολογικής ανοχής, έτσι ώστε να μπορέσουν να αναπτυχθούν εξατομικευμένες θεραπείες για τα αυτοάνοσα νοσήματα. Τέλος, απώτερος σκοπός είναι η γνώση από τη βασική έρευνα να μεταφραστεί στις ανθρώπινες ασθένειες, σε συνεργασία με κλινικούς συναδέλφους.

Το σύστημα του TNF στην απομυελίνωση και επαναμυελίνωση
Η επαναμυελίνωση είναι μια αυθόρμητη αναγεννητική διαδικασία του ενήλικου ΚΝΣ που ενεργοποιείται ως απόκριση στην καταστροφή της μυελίνης (8). Στη ΣΚΠ, η επαναμυελίνωση αποτυγχάνει σε μεγάλο βαθμό για άγνωστους λόγους, με αποτέλεσμα οι νευρολογικές βλάβες να είναι σταδιακά μη αναστρέψιμες, και οι απομυελινωμένοι άξονες να εκτίθενται συνεχώς σε φλεγμονώδη κυτταροτοξικά προϊόντα (9,10). Πρόσφατα ανακαλύψαμε έναν νέο ρόλο του διαλυτού TNF, μια σημαντικής προφλεγμονώδους κυτταροκίνης, ως ισχυρό αναστολέα της επαναμυελίνωσης σε ένα πειραματικό μοντέλό της προϊούσας ΣΚΠ, την cuprizone επαγόμενη απομυελίνωση. Η θεραπευτική χορήγηση σε ποντικούς ενός νέου εκλεκτικού αναστολέα του διαλυτού TNF (11), του XPro1595, όχι μόνο ελαττώνει τη φλεγμονή στον εγκέφαλο, αλλά επίσης προάγει ισχυρή επαναμυελίνωση των απομυελινωμένων αξόνων μέσω της ενίσχυσης της φαγοκυτταρικής δράσης της μικρογλοίας και της εκκαθάρισης των υπολειμμάτων κατεστραμμένης μυελίνης, επιτρέποντας έτσι στα πρόδρομα ολιγοδενδροκύτταρα να παράγουν νέα μυελίνη και νευροπροστασία (3,4).
Οι μοριακοί μηχανισμοί που ελέγχουν τη μετάπτωση των φαγοκυττάρων του ΚΝΣ, όπως της μικρογλοίας, από τον ευεργετικό στον επιβλαβή τους φαινότυπο κατά την φλεγμονή του εγκεφάλου, βρίσκονται τώρα υπό διερεύνηση, ώστε να εντοπιστούν νέοι στόχοι για την προαγωγή της επαναμυελίνωσης και της επιδιόρθωσης του ΚΝΣ με σκοπό να αναπτυχθούν νέες θεραπευτικές στρατηγικές για τη προϊούσα ΣΚΠ. Επιπρόσθετα, μελετάμε τη διαδικασία της επαναμυελίνωσης, εστιάζοντας σε κυτταρικό επίπεδο στην μελέτη της μικρογλοίας και των αστροκυττάρων καθώς και στις μεταξύ τους αλληλεπιδράσεις, κατά τη θεραπευτική χορήγηση του αναστολέα του διαλυτού TNF. (Το έργο αυτό πραγματοποιείται σε συνεργασία με τον Mr Raymond J. Tesi and Dr Christopher J. Barnum, CA, USA).
Αθηνά Μπούτου, Ηλίας Ρουφαγάλας, Κατερίνα Πολιτοπούλου
Ηλικία και κυτταρική γήρανση στην παθολογία της ΣΚΠ
Η προχωρημένη ηλικία είναι ο ισχυρότερος προγνωστικός παράγοντας για τη μετάβαση της ΣΚΠ από την υποτροπιάζουσα-διαλείπουσα φάση (RRMS) στη προϊούσα (PMS) (12,13). Οι αλλαγές που ευθύνονται για την ανάπτυξη μη αναστρέψιμης αναπηρίας είναι επομένως πιθανό να σχετίζονται με την ηλικία. Επομένως, μελετάμε τον τρόπο με τον οποίο η ηλικία επηρεάζει την ανάπτυξη εστιών στον εγκέφαλο σε ένα πειραματικό μοντέλο της προϊούσας ΣΚΠ (cuprizone επαγόμενη απομυελίνωση) για να εντοπίσουμε τους κυτταρικούς τύπους που μπορεί να είναι επιρρεπείς στη γήρανση (senescence) και να κατανοήσουμε τους μηχανισμούς με τους οποίους η κυτταρική γήρανση μπορεί να συμβάλλει στη μετάβαση της νόσου στην προοδευτική μορφή. Σκοπός μας είναι επίσης να αξιολογήσουμε εάν η αναστολή της κυτταρικής γήρανσης, με τη χρήση senomorphic φαρμάκων που διεισδύουν στον εγκέφαλο, μπορεί να αναζωογονήσει το ΚΝΣ ως πιθανή προσέγγιση για τη θεραπεία της προϊούσας ΣΚΠ.
Ειρήνη Παπαζιάν, Μαρία Κουρούβανη, Δημήτρης Παπαδόπουλος
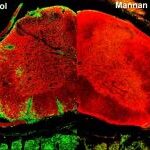
Αντιγόνο-ειδική θεραπεία για την αυτοανοσία
Η μελέτη των αυτοάνοσων αποκρίσων στο ΚΝΣ έχει στόχο την εύρεση νέων βιοδεικτών στο αίμα και στο εγκεφαλονωτιαίο υγρό για την παρακολούθηση της έναρξης και της εξέλιξης της νόσου σε ασθενείς με ΣΚΠ, καθώς και την εύρεση νέων πειραματικών στρατηγικών που θα στοχεύουν ειδικά μόνο τα κύτταρα του ανοσοποιητικού συστήματος που προκαλούν τη νόσο για θα αναπτυχθούν περαιτέρω εξατομικευμένες ανοσοθεραπείες στον άνθρωπο.
Η ΣΚΠ είναι μια αυτοάνοση νόσος του ΚΝΣ στην οποία τα αυτοδραστικά Τ λεμφοκύτταρα έναντι της μυελίνης θεωρείται ότι παίζουν κρίσιμο ρόλο. Οι μέχρι στιγμής διαθέσιμες θεραπείες καταστέλλουν με μη ειδικό τρόπο τη νόσο, είτε καταστέλλοντας γενικά τις ανοσολογικές αποκρίσεις, είτε εμποδίζοντας την εισχώρηση ανοσοκυττάρων στο ΚΝΣ. Έχουμε αναπτύξει μία νέα προσέγγιση για την ειδική αναστολή των Τ λεμφοκυττάρων και των μυελοειδών κυττάρων που προκαλούν την ασθένεια, σε ένα πειραματικό μοντέλο της υποτροπιάζουσας-διαλείπουσας ΣΚΠ, την πειραματική αυτοάνοση εγκεφαλομυελίτιδα (ΠΑΕ, EAE) (14). Τα πεπτίδια μυελίνης συζευγμένα με τη μαννάνη, έναν πολυσακχαρίτη του ζυμομύκητα, μπορούν να μειώσουν άμεσα τις φλεγμονώδεις απομυελινωτικές βλάβες στον νωτιαίο μυελό, όταν χορηγούνται σε ποντίκια που νοσούν. Η προστασία σχετίζεται με την εναλλακτική ενεργοποίηση των μυελοειδών κυττάρων στη περιφέρεια, με αποτέλεσμα αυτά να εμποδίζονται να εισχωρήσουν στο ΚΝΣ (15). Η προσέγγιση αυτή στοχεύει εκλεκτικά την αυτοάνοση απόκριση, χωρίς να έχει επιπτώσεις στις άλλες ανοσολογικές αποκρίσεις και προσφέρει μία ελπιδοφόρα και προσέγγιση για εξατομικευμένη ανοσοθεραπεία της ΣΚΠ. (Το έργο αυτό διεξάγεται σε συνεργασία με τον καθηγητή Θεόδωρο Τσέλιο, την Δρ. Μαριλένα Ανδρούτσου και τη Δρ. Μαρία Αναγνωστούλη).
Αναστασία Δαγκωνάκη, Αθηνά Παπαλάμπρου

Γονιδιωματική χαρτογράφηση ενδοκυττάριων και εξωκυττάριων μη-κωδικοποιών RNAs από βιολογικά υγρά ασθενών με Σκλήρυνση κατά Πλάκας και συσχέτισή τους με μονοπάτια του στρες
Με σκοπό την κατανόηση της ΣΚΠ σε γενετικό και επιγενετικό επίπεδο, στην παραπάνω έρευνα θα πραγματοποιηθεί μεταγραφομική ανάλυση δειγμάτων αίματος και εγκεφαλονωτιαίου υγρού (ΕΝΥ) καλά χαρακτηρισμένων ασθενών με ΣΚΠ. Η παρουσία διαφόρων μη κωδικοποιών RNA (ncRNA) θα αναλυθεί και θα συσχετιστεί με κλινικούς φαινοτύπους, με διαταραγμένα μονοπάτια του στρες, καθώς και με νευροανοσολογικά δίκτυα έκφρασης. Η ανίχνευση των παραπάνω ncRNAs θα μπορούσε να δώσει σημαντικές πληροφορίες σε για τους γενετικούς και επιγενετικούς παράγοντες που πυροδοτούν τη νόσο. Υπό αυτό το πρίσμα, θα πραγματοποιηθεί μεγάλης-κλίμακας χαρτογράφηση, σχολιασμός και ανάλυση της διαφορο-έκφρασης των παραπάνω ncRNAs από πειράματα ομικής, χρησιμοποιώντας εργαλεία και μεθόδους βιοπληροφορικής που έχουν αναπτυχθεί στο εργαστήριο, ενώ επιλεγμένα ncRNAs θα αναλυθούν περαιτέρω με τη στοχευμένη ανίχνευση των επιπέδων τους σε εξωσώματα που κυκλοφορούν στο πλάσμα και στο ΕΝΥ. Το αποτέλεσμα της συγκριτικής, βιοπληροφορικής ανάλυσης του μεταγραφώματος των κυττάρων του αίματος και του ΕΝΥ, σε συνδυασμό με την ανάλυση των εξωσωμάτων, αναμένεται να ρίξει φως στα δίκτυα που ρυθμίζονται από την αλληλεπίδραση του περιβάλλοντος με το έμφυτο ανοσοποιητικό και το ΚΝΣ, και στους παράγοντες που είναι ικανοί να διαπεράσουν τον αιματοεγκεφαλικό φραγμό και να προκαλέσουν φλεγμονή. Η παραπάνω έρευνα αναμένεται να συμβάλλει στην ανάπτυξη καινοτόμων βιοδεικτών στην ΣΚΠ, αλλά και στην ορθότερη επιλογή (παρακολούθηση σε πραγματικό χρόνο) των νοσοτροποποιητικών αγωγών που βρίσκονται ήδη στην κλινική πράξη (Το ερευνητικό έργο επιβλέπεται από τον Δρ. Αντώνη Γιαννακάκη και πραγματοποιείται σε συνεργασία με τη Δρ. Μαρία Αναγνωστούλη).
Βασίλης Γουζούασης, Αντώνης Γιαννακάκης
Η ομάδα μας μελετά την μικρογλοία του εγκεφάλου και σκοπεύει στην αποσαφήνιση του ρόλου που διαδραματίζει στην παθολογία νευρο-ανοσολογικών διαταραχών. Χρησιμοποιούμε πειραματικά μοντέλα ΣΚΠ και χρησιμοποιούμε εργαστηριακές τεχνικές όπως η in vivo βιοαπεικόνιση κυττάρων του εγκεφάλου με τη χρήση διφωτονικού μικροσκοπίου καθώς και σε μοριακές, ανοσολογικές και υπολογιστικές τεχνικές ανάλυσης εικόνας (16-18).
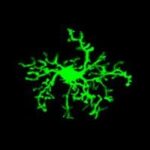
Η δυναμική της μικρογλοίας στην απομυελίνωση και τη νευροφλεγμονή
Τα μικρογλοιακά κύτταρα είναι μακροφάγα που εντοπίζονται στο εγκεφαλικό παρέγχυμα με διάφορες λειτουργίες στην υγεία και τις ασθένειες. Είναι κύτταρα υψηλής κινητικότητας που διαρκώς επεκτείνουν και ανασύρουν τις προεκβολές τους, πραγματοποιώντας την επιτήρηση του εγκεφάλου, μια ομοιοστατική λειτουργία με την οποία σαρώνουν τον ιστό για πιθανές λοιμώξεις, ιστικές βλάβες και άλλες παθολογικές καταστάσεις με σκοπό την επίλυσή τους. Υπό παθολογικές συνθήκες αλλάζουν τη μορφολογία και τις λειτουργίες τους και μπορεί να έχουν τόσο ευεργετικό όσο και επιζήμιο ρόλο, ανάλογα με τη νόσο. Η ομάδα μας μελετά το πώς η μικρογλοία του εγκεφάλου συμπεριφέρεται στην απομυελίνωση και πώς αλλάζει η μορφολογία και η κινητικότητά της κατά την ανάρρωση/επαναμυελίνωση. Για τον σκοπό αυτό, αναπτύξαμε μια νέα προσέγγιση ιστοπαθολογικής ανάλυσης σε 3D και ένα εργαλείο ανάλυσης σε επίπεδο μεμονωμένου κυττάρου (https://github.com/VKyrargyri/MicroApp) που όταν εφαρμόστηκε στο μοντέλο απομυελίνωσης μέσω της τοξίνης cuprizone αποκάλυψε αλλαγές στη μορφολογία της μικρογλοίας που εξαρτώνται από την περιοχή του εγκεφάλου στην οποία βρίσκονται αλλά και το στάδιο της νόσου (17). Τώρα χρησιμοποιούμε παρόμοιες προσεγγίσεις με σκοπό να χαρακτηρίσουμε τυχόν ευαίσθητες αλλαγές στη δυναμική της μικρογλοίας κατά τη διάρκεια της νευροφλεγμονής στο μοντέλο της ΠΑΕ.
Βασιλική Κυραργύρη, Ηλίας Ρουφαγάλας, Μαρία Αυλωνίτη, Μάρια Γκομίνη
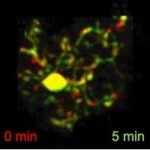
Διαφοροποίηση του ρόλου της μικρογλοίας του εγκεφάλου από τα μακροφάγα της περιφέρειας σε μοντέλα ΣΚΠ
Τα μακροφάγα που κατοικούν στο ΚΝΣ, στα οποία περιλαμβάνεται η μικρογλοία μαζί με τα περιαγγειακά, μηνιγγικά και τα μακροφάγα του χοριοειδούς πλέγματος, έχουν κοινή κυτταρική προέλευση με τα μακροφάγα στους περιφερικούς ιστούς. Ως αποτέλεσμα, μοιράζονται κοινές μοριακές σημάνσεις καθιστώντας δύσκολη τη διαφοροποίηση των λειτουργιών τους σε νευροφλεγμονώδεις ασθένειες, όπως η ΣΚΠ, στις οποίες τα περιφερειακά μακροφάγα εισβάλλουν στο ΚΝΣ. Για να αντιμετωπιστεί αυτό, χρησιμοποιούμε προσεγγίσεις γονιδιακής στόχευσης, ανοσολογικές τεχνικές, γενετικές προσεγγίσεις και βιοπληροφορική και επιδιώκουμε να διευκρινίσουμε τον ειδικό ρόλο του NF-κΒ μεταγραφικού παράγοντα της μικρογλοίας του εγκεφάλου έναντι των μακροφάγων άλλων ιστών της περιφέρειας στην εξέλιξη της νευροφλεγμονής στο μοντέλο ΠΑΕ της ΣΚΠ.
Βασιλική Κυραργύρη, Μαρία Αυλωνίτη, Μάρια Γκομίνη, Αδαμαντία Μητροπούλου
Ο στόχος της Ομάδας Καμπά είναι η μεταφραστική έρευνα με την αρχή «από την κλίνη του ασθενή στον εργαστηριακό πάγκο και πίσω στον ασθενή». Το βασικό ερευνητικό ενδιαφέρον της ομάδας είναι οι μηχανισμοί ασθενειών υπό το πρίσμα της ανοσολογίας και πιο συγκεκριμένα της φυσικής ανοσίας. Βασικοί ερευνητικοί στόχοι είναι τα ουδετερόφιλα και οι λειτουργίες τους, όπως οι εξωκυτταρικές παγίδες ουδετερόφιλων (NETs), άλλοι πληθυσμοί της φυσικής ανοσίας και η συμβολή τους σε ασθένειες, η αιμοποίηση καθώς και πιο κεντρικοί μηχανισμοί που επηρεάζουν ανοσολογικές αποκρίσεις όπως η αυτοφαγία. Τα επιστημονικά ενδιαφέροντα διακρίνονται τόσο σε λοιμώδεις όσο και σε μη-λοιμώδεις νόσους.
Ουδετερόφιλα και NETs
Τα ουδετερόφιλα αποτελούν ένα από τα βασικά ερευνητικά ενδιαφέροντα αυτής της ομάδας. Τα κύτταρα αυτά δεν έχουν μελετηθεί εκτενώς λόγω των αυστηρών συνθηκών χειρισμού που απαιτούν και καθιστούν τις συνθήκες καλλιέργειάς τους δύσκολες. O Δρ. Κάμπας και η ομάδα του έχουν εφαρμόσει και βελτιστοποιήσει όλα τα πρωτόκολλα που αφορούν στο χειρισμό και στην καλλιέργεια ανθρώπινων ουδετερόφιλων στο ΕΙΠ κατά τη διάρκεια της θητείας του. Ένας εντυπωσιακός μηχανισμός αυτών των κυττάρων που είναι μοναδικός σε αυτά σε συνθήκες in vivo, είναι η απελευθέρωση εξωκυτταρικών παγίδων ουδετερόφιλων (NETs). Άλλοι κυτταρικοί τύποι επιδεικνύουν την ικανότητα εκτέλεσης αυτής της λειτουργίας αλλά μόνο υπό συνθήκες in vitro. Αυτά τα δίκτυα χρωματίνης «διακοσμούνται» από μια πληθώρα πρωτεϊνών οι οποίες μεταβάλλονται ανάλογα με το φλεγμονώδες περιβάλλον, δίνοντάς τους τη δυνατότητα να συμβάλλουν σε μια ποικιλία παθοφυσιολογικών καταστάσεων (αυτοανοσία/αυτοφλεγμονή, θρόμβωση, ίνωση, καρκίνος). Η ομάδα μελετά επίσης τους διάφορους κεντρικούς μηχανισμούς που συμμετέχουν στη δημιουργία αυτών των δομών, όπως η αυτοφαγία (19). Η αυτοφαγία, εν γένει, αποτελεί έναν βασικό ανοσορυθμιστικό μηχανισμό ρυθμίζοντας τόσο τις έμφυτες όσο και τις επίκτητες ανοσολογικές αποκρίσεις.
Επιπλέον, είναι μία από τις λίγες ομάδες παγκοσμίως που καταφέραν να καλλιεργήσουν in vitro πλήρως λειτουργικά ουδετερόφιλα (κοκκιοκύτταρα) από αιμοποιητικά βλαστοκύτταρα (CD34) από μυελό των οστών ανθρώπινων δοτών (20).
Φυσική ανοσία και λοιμώξεις
Υπάρχει ιδιαίτερα περιορισμένη έρευνα επάνω στην αλληλεπίδρασή της πλειονότητα των μικροοργανισμών με έμφυτους ανοσοποιητικούς πληθυσμούς και πιο συγκεκριμένα με ουδετερόφιλα, παρόλο που τα ουδετερόφιλα αποτελούν την πρώτη γραμμή άμυνας της ανοσίας. Στόχος της ομάδας είναι να προσπαθήσει να γεφυρώσει τις έμφυτες ανοσολογικές αποκρίσεις, όπως η φαγοκυττάρωση των ουδετερόφιλων, η αποκοκκίωση και η δημιουργία NETs ως απάντηση σε διάφορα ενδοκυτταρικά παθογόνα. Οι τρέχουσες ερευνητικές μελέτες της ομάδας αφορούν στις λοιμώξεις από H. pylori, Legionella και Bartonella και στον τρόπο που συμβάλλει το ανοσοποιητικό σύστημα στην παθοφυσιολογία που προέρχεται από αυτά τα παράσιτα (γαστρίτιδα/γαστρική μεταπλασία, λεμφαδενίτιδα κ.λπ.).
Μυρτώ Κουτάντου, Έλενα Πέτρου
Φυσική ανοσία και μη-λοιμώδεις νόσοι
Η ομάδα διερευνά τις έμφυτες ανοσοαποκρίσεις σε καταστάσεις στείρας φλεγμονής, ως συνέχεια του ερευνητικού ενδιαφέροντος Δρ. Καμπά τα προηγούμενα χρόνια σε άλλες ερευνητικές ομάδες. Η κύρια εστίαση είναι η συμμετοχή των ουδετερόφιλων στην παθοφυσιολογία των αυτοάνοσων/αυτοφλεγμονωδών, θρομβωτικών και ινωτικών διαταραχών. Επί του παρόντος, η ομάδα ερευνά τη συμμετοχή ουδετερόφιλων και NETs στη γιγαντοκυτταρική αρτηρίτιδα (21), στο αντιφωσφολιπιδικό σύνδρομο και στη ρευματοειδή αρθρίτιδα. Οι προσπάθειες της ομάδας επικεντρώνονται στον εντοπισμό των κεντρικών μηχανισμών που θα μπορούσαν να χρησιμοποιηθούν ως θεραπευτικοί στόχοι σε αυτές τις ασθένειες. Σύμφωνα με τα παραπάνω, η ομάδα θα επεκτείνει το ερευνητικό της πεδίο επίσης στη μελέτη των αντιφλεγμονωδών λιπιδικών μεσολαβητών (ρεσολβίνες/προρεσολβίνες) στις παραπάνω διαταραχές ως μέσα εναντίον της ουδετερόφιλης ενεργοποίησης. Επιπλέον, η ομάδα θα μελετήσει την κυτταρικής γήρανση (senescence) ως πρόσθετο μηχανισμό που θα μπορούσε να επηρεάσει το φλεγμονώδες περιβάλλον σε αυτές τις διαταραχές.
Σταύρος Ναούμ, Δημήτριος Παλαμιδάς, Φώτης Μπαντούνας, Αθανάσιος Δ. Μπακάσης
Η ομάδα χρησιμοποιεί μοριακά και γενετικά εργαλεία όπως ο ανασυνδυασμός Cre/loxP σε ποντίκια σε προκλινικά πειραματικά μοντέλα της ανθρώπινης νόσου, κυτταρομετρία ροής, μικροσκοπία και πιο πρόσφατα single cell RNA sequencing, σε συνδυασμό με εργαλεία βιοπληροφορικής, για να μελετήσει τους κυτταρικούς και μοριακούς μηχανισμούς της παθολογίας του ΚΝΣ. Τα πειραματικά μοντέλα που χρησιμοποιούνται περισσότερο στο εργαστήριο είναι η ΠΑΕ (experimental autoimmune encephalomyelitis, EAE), η οποία προσομοιάζει τα αυτοάνοσα χαρακτηριστικά της ΣΚΠ (22) και η επαγόμενη από cuprizone απομυελίνωση, η οποία είναι κατάλληλη για τη μελέτη της διαδικασίας της απομυελίνωσης και επαναμυελίνωσης, προσομοιάζοντας σημαντικές διαδικασίες της προοδευτικής μορφής της ΣΚΠ (PMS), όπως η οξειδωτική καταστροφή παρουσία χρόνιων ενεργοποιημένων μικρογλοιακών κυττάρων (23). Είναι επίσης διαθέσιμα in vivo και in vitro μοντέλα για την επιληψία και τη διεγερτοτοξικότητα του γλουταμινικού οξέος.
Η έρευνά μας πραγματοποιείται σε στενή συνεργασία με τις τεχνολογικές πλατφόρμες του Ελληνικού Ινστιτούτου Παστέρ, ειδικά με την Μονάδα Διαγονιδιακής Τεχνολογίας (επικεφαλής κ. Φώτης Μπαντούνας), η οποία διατηρεί ένα πλήθος διαγονιδιακών ποντικών για τη μελέτη του ανοσοποιητικού συστήματος και τη μελέτη ασθενειών, καθώς και με τo
Τμήμα Ζωικών Προτύπων Βιοιατρικής Έρευνας . Επίσης υπάρχει στενή συνεργασία με τη Μονάδα Οπτικής Μικροσκοπίας, η οποία είναι εξοπλισμένη με σύγχρονα μηχανήματα κυτταρομετρίας ροής, συνεστιακά μικροσκόπια (confocal, 2-photon), καθώς και σε συνεργασία με ειδικούς εξωτερικούς συνεργάτες από τους τομείς του single cell RNA sequencing, της βιοπληροφορικής, της ανάπτυξης φαρμάκων και των κλινικών μελετών.
| 2020-2023 | Ελληνικό Ίδρυμα Έρευνας & Καινοτομίας (ΕΛΙΔΕΚ) – Ερευνητικά Έργα μελών ΔΕΠ/Ερευνητών-τριών με τίτλο “Enhancing the beneficial functions of CNS macrophages to promote remyelination as a prototypic therapeutic strategy for the treatment of progressive multiple sclerosis”, και ακρωνύμιο “MacRepair” (Ref: HFRI-FM17-2900). Κύρια ερευνήτρια L. Probert. Διάρκεια 36 μήνες (28/02/2020-27/02/2023). Συνολικός προϋπολογισμός 179.957,12 €. |
| 2020-2023 | Hellenic Ministry of Development and Investment, Γενική Γραμματεία Έρευνας και Καινοτομίας – (ΓΓΕΚ) – Εμβληματική Δράση «Εθνικό Δίκτυο Έρευνας Γενετικών Νευροεκφυλιστικών Παθήσεων (ΕΔΙΑΝ)» η οποία εντάσσεται στο έργο «Υποδομές Εθνικών Ερευνητικών Δικτυών Στους Τομείς της Ιατρικής Ακριβείας και της Κλιματικής Αλλαγής» (Ref: 2018ΣΕ01300001). Διάρκεια 36 μήνες (19/05/2020-18/05/2023). Συνολικός προϋπολογισμός του έργου 2.100.000,00 €; Συμμετοχή ΕΙΠ με συντονίστρια Ρεβέκκα Μάτσα, 150.000,00 €; Συμμετοχή L. Probert 25.000,00 €. |
| 2019-2022 | Ελληνική Ακαδημία Νευροανοσολογίας (ΕΛΛΑΝΑ) – Ερευνητικό πρόγραμμα με τίτλο “Human multiple sclerosis CNS microenvironment immunoprofiling: Proof-of-principle for establishment of an integrated pipeline for biobank and analysis of MS samples” και με ακρωνύμιο «MS Biobank», Συντονιστές Lesley Probert & Γιώργος Κόλλιας, Κύρια ερευνήτρια L. Probert. Διάρκεια 40 μήνες (09/2019-09/2022). Συνολικός προϋπολογισμός ΕΙΠ 48.418,00 €. |
| 2018-2021 | Ελληνικό Ίδρυμα Έρευνας & Καινοτομίας (ΕΛΙΔΕΚ) – Ερευνητικών Έργων ΕΛΙΔΕΚ για την Ενίσχυση Μεταδιδακτόρων Ερευνητών/Τριών στην Βασιλική Κυραργύρη για τη στήριξη ανεξάρτητης μεταδιδακτορικής έρευνας με τίτλο “Microglia-driven pathology and brain surveillance in demyelination’’ και με ακρωνύμιο «MicroMS», Act 1156. Διάρκεια 39 μήνες (22/10/2018-21/01/2022). Συνολικός προϋπολογισμός 180.000,00 €. |
| 2018-2021 | Γενική Γραμματεία Έρευνας και Καινοτομίας (ΓΓΕΚ) – Ερευνητικό πρόγραμμα Ερευνώ-Δημιουργώ-Καινοτομώ με τίτλο «Ανάπτυξη ενός προηγμένου ανθρωποποιημένου μοντέλου ποντικού για την σκλήρυνση κατά πλάκας: εφαρμογή σε προ-κλινικές μελέτες και δοκιμές νέων φαρμάκων», με ακρωνύμιο “ΑΚΕΣΩ” (Τ1ΕΔΚ01859). Συντονίστρια M. Ανδρούτσου, Επιστημονική Υπεύθυνη και Κύρια Ερευνήτρια L. Probert. Διάρκεια 36 μήνες (06/09/2018 – 05/09/2022). Συνολικός προϋπολογισμός 834.900,71 €, Συμμετοχή L. Probert 397.680,71 €. |
| 2017-2018 | MS Society, UK – Ερευνητικό πρόγραμμα με τίτλο “Is cellular senescence responsible for disability progression in progressive multiple sclerosis? Κύριος ερευνητής R. Nicholas, Imperial College, London, UK. Συμμετοχή L. Probert. Διάρκεια 9 μήνες (14/05/2018-06/05/2019). Προϋπολογισμός 40.000,00 UKP. |
| 2017-2019 | Γενική Γραμματεία Έρευνας και Καινοτομίας (ΓΓΕΚ) – Πράξη «Λοιμώδη, Αυτοάνοσα και Νευροεκφυλιστικά νοσήματα: Μελέτη παθογενετικών μηχανισμών και ανάπτυξη διαγνωστικών, προγνωστικών και θεραπευτικών προσεγγισεών», με κωδικό ΟΠΣ MIS 5002486, ακρωνύμιο «KRIPIS II», η οποία έχει ενταχθεί στη Δράση «Στρατηγική Ανάπτυξης Ερευνητικών και Τεχνολογικών Φορέων» του Επιχειρησιακού Προγράμματος Επιχειρηματικότητα Ανταγωνιστικότητα και Καινοτομία (ΕΠΑνΕΚ). Συντονιστής: Ελληνικό Ινστιτούτο Παστέρ (Δρ. E. Καραγκούνη). Συμμετοχή L. Probert. Διάρκεια 24 μήνες (Οκτώβριος 2017-Οκτώβριος 2019). Προϋπολογισμός ~25.000,00 €. |
| 2016-2019 | Multiple Sclerosis Trials Collaboration, UK – ερευνητικό πρόγραμμα με τίτλο “The role of cellular aging in disability progression in multiple sclerosis”. Κύριοι ερευνητές L. Probert & Δ. Παπαδόπουλος. Διάρκεια 36 μήνες (01/03/2016-01/03/2019). Προϋπολογισμός 80.400,00 €. |
Το εργαστήριο εμπλέκεται ενεργά στην οργάνωση και την υλοποίηση των παρακάτω δραστηριοτήτων:
- European School of Neuroimmunology (ESNI) (esni.org).
- ESNI Journal Club, το οποίο συντονίζεται από την Dr Maja Jagodic (Karolinska Institutet, SE) και Ms Stine Overdal (https://esni.isniweb.org/esni-journal-club-with-authors-tuesday-march-30-2021/).
- International Society of Neuroimmunology (ISNI) (isni.org).
- Ελληνική Ακαδημία Νευροανοσολογίας (www.helani.gr).
2021
Boziki M, Styliadis C, Bakirtzis C, Grigoriadou E, Sintila AS, Nikolaidis I, Vrienniou A, Geys L, Pelidou SH, Probert L, Papazisis G, Bamidis P, Grigoriadis N. (2021). A National Representative, Cross-Sectional Study by the Hellenic Academy of NeuroImmunology (HEL.A.NI.) on COVID-19 and Multiple Sclerosis: Overall Impact and Willingness Toward Vaccination. Front. Neurol. 2021 Nov 25;12: 757038. doi: 10.3389/fneur.2021.757038. eCollection 2021.
Palamidas DA, Argyropoulou OD, Georgantzoglou N, Karatza E, Xingi E, Kapsogeorgou EK, Anagnostopoulos CD, Lazaris AC, Ritis K, Goules AV, Kambas K, Tzioufas AG. Neutrophil extracellular traps in giant cell arteritis biopsies: presentation, localization and co-expression with inflammatory cytokines. Rheumatology (Oxford). 2021 Jul 14:keab505.
Papazian I, Tsoukala E, Boutou A, Karamita M, Kambas K, Iliopoulou L, Fischer R, Kontermann RE, Denis MC, Kollias G, Lassmann H, Probert L. (2021). Fundamentally different roles of neuronal TNF receptors in CNS pathology: TNFR1 and IKKβ promote microglial responses and tissue injury in demyelination while TNFR2 protects against excitotoxicity in mice. J. Neuroinflamm. 2021 Sep 26; 18(1): 222. doi: 10.1186/s12974-021-02200-4.
Roufagalas I, Avloniti M, Fortosi A, Xingi E, Thomaidou D, Probert L, Kyrargyri V. (2021). Novel cell-based analysis reveals region-dependent changes in microglial dynamics in grey matter in a cuprizone model of demyelination. Neurobiol. Dis. 2021 Sep; 157: 105449. doi: 10.1016/j.nbd.2021.105449. Epub 2021 Jul 16.
Stergiou IE, Kambas K, Poulaki A, Giannouli S, Katsila T, Dimitrakopoulou A, Vidali V, Mouchtouris V, Kloukina I, Xingi E, Pagakis SN, Probert L, Patrinos GP, Ritis K, Tzioufas AG, Voulgarelis M. (2021). Exploiting the role of hypoxia-inducible factor 1 and pseudohypoxia in the myelodysplastic syndrome pathophysiology. Int. J. Mol. Sci. 2021 Apr 15;22(8): 4099. doi: 10.3390/ijms22084099.
2020
Daskalakis K, Alexandraki KI, Kloukina I, Kassi E, Felekouras E, Xingi E, Pagakis SN, Tsolakis AV, Andreakos E, Kaltsas G, Kambas K. Increased autophagy/mitophagy levels in primary tumours of patients with pancreatic neuroendocrine neoplasms. Endocrine. 2020 May;68(2):438-447.
Dagkonaki A, Avloniti M, Evangelidou M, Papazian I, Kanistras I, Tseveleki V, Lampros F, Tselios T, Jensen LT, Möbius W, Ruhwedel T, Androutsou ME, Matsoukas J, Anagnostouli M, Lassmann H, Probert L. (2020). Mannan-MOG35-55 reverses experimental autoimmune encephalomyelitis, inducing a peripheral type 2 myeloid response, reducing CNS inflammation, and preserving axons in spinal cord lesions. Front. Immunol. 2020 Nov 19;11: 575451. doi: 10.3389/fimmu.2020.575451. eCollection 2020.
Pegoretti V, Swanson KA, Bethea JR, Probert L, Eisel ULM, Fischer R (2020). Inflammation and oxidative stress in multiple sclerosis: consequences for therapy development. Oxid. Med. Cell Longev. 2020 May 12;2020: 7191080. doi: 10.1155/2020/7191080. eCollection 2020.
Probert L, Quintana FJ, Bar-Or A. (2020). Editorial: update on translational neuroimmunology - Research of ISNI 2018. Front. Immunol. 2020 Sep 30;11: 2012. doi: 10.3389/fimmu.2020.02012. eCollection 2020.
Kyrargyri, V., Madry, C., Rifat, A., Arancibia-Carcamo, I. L., Jones, S. P., Chan, V. T. T., … Attwell, D. (2020). P2Y (13) receptors regulate microglial morphology, surveillance, and resting levels of interleukin 1β release. Glia, 68(2), 328–344. https://doi.org/10.1002/glia.23719
2019
Kyrargyri V., Attwell D., Jolivet RB., Madry C. (2019). Analysis of signaling mechanisms regulating microglial process movement. Methods Mol Biol, 2034:191-205; doi: 10.1007/978-1-4939-9658-2_14.
2018
Papazian I, Voulgari-Kokota A, Kyrargyri V, Evangelidou M, Probert L. (2018). Mesenchymal stem cell protection of neurons against glutamate excitotoxicity involves reduction of NMDA-triggered calcium responses and surface GluR1 and is partly mediated by TNF. Int. J. Mol. Sci. 2018, 19, 651; doi:10.3390/ijms19020651.
2017
Karamita M, Barnum C, Mobius W, Tansey MG, Szymkowski DE, Lassmann H, Probert L. (2017). Therapeutic inhibition of soluble brain TNF promotes remyelination by increasing myelin phagocytosis by microglia. J. Clin. Invest. Insight, Apr 20; 2(8). pii: 87455. doi: 10.1172/jci.insight.87455. [Epub ahead of print].
2015
Probert L. (2015). TNF and its receptors in the CNS: the essential, the desirable and the deleterious effects. Neuroscience Aug 27:302:2-22. doi: 10.1016/ j.neuroscience. 2015.06.038. Epub 2015 Jun 24. Review.
Tseveleki V, Tselios T, Kanistras I, Koutsoni O, Karamita M, Vamvakas SS, Apostolopoulos V, Dotsika E, Matsoukas J, Lassmann H, Probert L. (2015). Mannan-conjugated myelin peptides prime non-pathogenic Th1 and Th17 cells and ameliorate experimental autoimmune encephalomyelitis. Exp. Neurol. 267:254-67; doi: 10.1016/j.expneurol.2014.10.019. Epub 2014 Oct 30.
Kyrargyri V, Vega-Flores G, Gruart A, Delgado-Garcia JM, Probert L. (2015). Differential contributions of microglia and neuronal IKKβ to synaptic plasticity and associative learning in alert behaving mice. Glia Apr; 63 (4): 549-566; doi: 10.1002/glia.22756. Epub 2014 Oct 9.
Evangelidou M, Karamita M, Vamvakas SS, Szymkowski DE, Probert L. (2015). Altered expression of oligodendrocyte and neuronal marker genes predicts the clinical onset of autoimmune encephalomyelitis and indicates the effectiveness of multiple sclerosis-directed therapeutics. J. Immunol. May ;192(9):4122-33. doi: 10.4049/jimmunol.1300633. Epub 2014 Mar 28.




Παλαμιδάς Δημήτριος

Μπακάσης Αθανάσιος


